中国医学论坛报
贾建平 武力勇 秦伟 李丹 邢怡 左秀美
首都医科大学宣武医院神经内科?
?
阿尔茨海默病 ( AD ) 是一种以记忆障碍为核心的、慢性进行性老年疾病。目前认为,AD是一个从开始有病理改变到出现临床症状的连续疾病过程,病理生理改变在出现临床症状的 15~20年前就已经开始。2011年美国国家老化研究所 ( NIA ) 和AD协会 ( AA ) 推荐了新的AD诊断标准,明确提出AD是一个连续的过程,包括痴呆前阶段和痴呆阶段,痴呆前阶段又分为轻度认知障碍期 ( MCI ) 和轻度认知障碍前期 ( pre-MCI期 ) 。MCI期指出现记忆障碍但不影响日常生活能力,同时伴随不同程度的神经病理改变;pre-MCI期,也称为临床前期,指没有临床表现或临床症状极其轻微但已出现神经病理改变。AD的病理改变可用生物标志物来监测。MCI和pre-MCI期生物标志物的研究将有助于AD的痴呆前诊断,为进一步预防和治疗提供重要依据。
概述
AD 的病理生理改变主要有淀粉样蛋白沉积和神经退行性变。反映淀粉样蛋白沉积的标志物主要有正电子发射断层扫描 ( PET ) 淀粉样蛋白成像和体液[脑脊液 ( CSF ) 和血液]中的β淀粉样蛋白 ( Aβ ) 42/Aβ40浓度;反映神经退行性变的标志物包括脑功能降低[表现为18氟-氟代脱氧葡萄糖 ( 18F- FDG ) 摄入减少和功能磁共振 ( fMRI ) 显示的静息网络连接性下降]、T1结构MRI显示的脑萎缩及CSF的总tau和磷酸化tau ( p-tau ) 浓度增加。
最近,杰克 ( Jack ) 教授提出AD动态生物标志物瀑布假说 ( dynamic biomarker cascade ) ,认为淀粉样蛋白病理改变和神经退行性变在AD临床症状出现之前均已发生,淀粉样蛋白病理变化是引起AD神经退行性变进而导致痴呆发生的最早事件,神经退行性病理变化的先后顺序依次为脑功能降低、tau蛋白过度磷酸化以及突触和细胞缺失。此假说推测AD临床各期 ( 包括pre-MCI期、 MCI期和痴呆期 ) 均有反映其病理生理特点的特异性标志物 ( 图1 ) 。
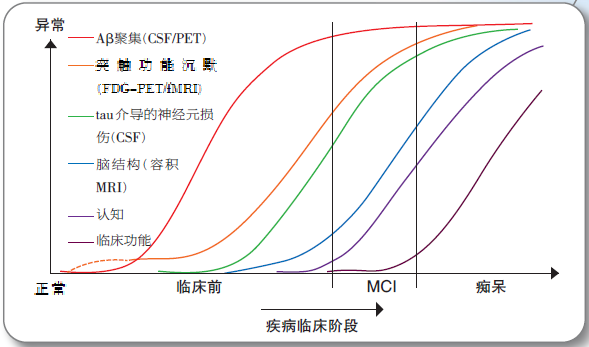
体液标志物
脑脊液
由于CSF直接与脑组织接触,可直接反映脑组织的病理改变 ( Aβ反映脑淀粉样蛋白沉积,tau反映神经退行性变 ) ,且检查费用低廉,故被视为理想的生物标志物来源。AD痴呆期患者可出现特征性CSF表现:Aβ42降低、总tau和p-tau升高。CSF不仅可作为AD痴呆期的诊断标志物,AD特征性CSF变化 ( Aβ42降低和tau蛋白升高 ) 还可用于预测MCI的转归。研究显示,将来转化为痴呆的MCI患者在基线期的CSF Aβ42和tau改变与AD痴呆患者类似,而未转化为痴呆的MCI患者CSF与健康对照无异。一些研究也探索了这些标志物是否可用于发现AD的pre- MCI期患者。两项基于人群的研究结果显示,转归为AD的认知正常老年人的CSF Aβ42下降,但总tau和p-tau则无显著变化,说明淀粉样蛋白病理改变早于tau的病理变化。一项家族性AD研究显示,家族性AD基因携带者在出现临床症状前的15~20年 ( 即pre-MCI期 ) 即已出现CSF Aβ42显著下降、总tau和p-tau升高,提示AD临床前期就已存在与AD痴呆期相同的CSF改变,CSF有可能作为pre-MCI期诊断的生物标志物。
外周血
血液由于易于获得和检测,是临床寻找早期AD诊断标志物的理想标本。研究表明,来源于血液的标志物可用于提高MCI和痴呆的诊断准确度及预测和监测MCI的转归。由于Aβ被认为在AD发病机制中起着关键作用,血液中的Aβ成为近年来研究较为深入的生物标志物。多项研究表明,AD患者血浆Aβ42显著升高,且 MCI患者中血浆Aβ42水平较年龄匹配的正常对照增高,但血浆Aβ42尚未作为稳定的生物标志物被广泛接受。
影响标志物研究进展
淀粉样蛋白PET
多项研究已证实,淀粉样蛋白沉积是AD最早的病理改变,但淀粉样蛋白的沉积程度与AD病情进展变化的关系尚不清楚。PET淀粉样蛋白成像是测量活体脑内淀粉样蛋白沉积最直接的方法,匹兹堡复合物B ( PIB ) 是第一个用于临床的淀粉样蛋白PET试剂。与半衰期只有半小时的淀粉样蛋白标记物11C-PIB相比,18F-AV-45最大的优点是半衰期长 ( 可达2.5小时 ) ,适于多中心研究,该标志物已被用于美国和加拿大的神经影像危险因素 ( ADNI ) 研究。18F-AV-45可直接显示脑内淀粉样蛋白沉积的部位、方式、面积和程度。
一项MCI期患者的18F- AV-45PET研究显示,在MCI早期患者已出现明显的淀粉样蛋白沉积,在MCI晚期脑淀粉样蛋白沉积已达到高峰 ( 即平台期 ) 。小样本病例研究显示,家族性AD在无症状期 ( 即pre-MCI期 ) 即使尚未出现脑萎缩和脑代谢减低,即已出现了脑内淀粉样蛋白沉积,说明PET淀粉样蛋白成像可能对pre- MCI具有一定诊断价值,且有可能是最早出现的生物标志物。非痴呆老年人长期淀粉样蛋白成像PET随访研究显示,认知正常的老年人可出现淀粉样蛋白沉积,且随年龄增长而逐渐增加。依据淀粉样蛋白级联瀑布学说,18F-AV-45标记的淀粉样蛋白沉积有望成为诊断pre-MCI的早期生物标志物。
葡萄糖代谢PET
AD 患者的突触功能变化可通过18F-FDG PET来检查和评价。18F-FDG PET已在临床上用于AD痴呆期的诊断和鉴别诊断,痴呆患者可存在颞顶和上颞/后颞区、后扣带回皮质和楔前叶葡萄糖代谢降低;初步研究显示,pre- MCI期患者可能出现脑部葡萄糖代谢下降,但也有研究显示,脑部葡萄糖代谢率在MCI期才会显著下降。
结构磁共振
结构MRI可检测到因轴突退变、突触和细胞死亡而导致的区域性或全脑萎缩。海马和颞叶内侧体积是经典的测量指标,一般认为,颞叶内侧结构,例如海马和内嗅皮质萎缩,发生于痴呆症状出现之前即MCI期。近年来的研究显示,MCI患者可出现皮质厚度变薄和全脑体积变小,且这两项指标还用于预测MCI是否发展为痴呆。尽管多数研究者认为脑结构异常往往发生在脑淀粉样沉积和脑功能异常之后,但2012年的一项类似研究显示,家族性AD患者在出现临床症状前的5年即可出现AD特征性的皮层萎缩。除了皮层萎缩,2013年来自美国李 ( Lee ) 和英国瑞安 ( Ryan ) 的两项不同研究得出了一致的结果,无症状的家族性AD基因突变携带者出现了皮层下核团的萎缩,下丘脑、豆状核和尾状核都出现了体积减小。
功能磁共振 ( fMRI )
静息态fMRI是近年来出现的一项新的研究脑功能的技术,多项静息态fMRI研究已证实,AD痴呆期患者存在静息态默认网络、注意网络、执行功能网络等的功能连接性下降。一项遗忘型MCI的执行控制网络研究显示,遗忘型MCI患者不仅可出现脑功能连接的下降,还可出现部分脑区功能连接的增强,提示在MCI阶段出现功能连接的损害 ( 下降 ) 和代偿 ( 增强 ) 并存。最近,几项不同的研究均显示具淀粉样蛋白沉积但认知功能正常的老年人已存在与记忆相关的静息态网络连接性下降,甚至携带载脂蛋白 ( APOE ) ε4基因的认知正常老年人即便没有淀粉样蛋白沉积,也可出现静息态功能网络连接的改变。这些研究结果提示脑功能障碍可能在pre-MCI期即已出现,静息态fMRI有可能成为诊断pre-MCI的早期生物标志物之一。
小结
综上所述,AD的生物标志物是目前AD研究的热点,生物标志物在AD ( 特别是MCI和pre-MCI期 ) 的诊断中具一定临床意义。NIA-AA诊断标准引入了CSF和影像学标志物,并将这些生物标志物分为两类:其一为脑Aβ沉积的标志物,脑脊液Aβ42降低和PETAβ显像;其二为神经元损伤的生物标志物,包括脑脊液tau蛋白升高、FDGPET显示颞顶叶皮质葡萄糖代谢下降和结构MRI显示颞叶基底部、内侧或外侧萎缩、顶叶内侧皮质萎缩。